Sebelumnya telah dijabarkan asal mula fisika Kuantum. Kali ini kita akan bahas lebih ke persamaan matematisnya
Persamaan Schrödinger
Secara sederhana Erwin Schrödinger memformulakan gerak elektron dengan persamaan
\(\hat{H}\ \Psi=E\ \Psi\ \cdots\ (1)\)
Persamaan ini dikenal sebagai Persamaan Schrödinger tidak bergantung waktu (Time Independent Schrödinger Equation, TISE). Yang mana
- \(\hat{H}\) adalah operator Hamilton dengan \(\hat{H}=\hat{T}+\hat{V}\). Di mana \(\hat{T}\) adalah operator Energi Kinetik (sudah disinggung di atas) dan \(\hat{V}\) adalah operator Energi Potensial
- \(\Psi\) adalah fungsi gelombang (merupakan solusi dari Persamaan Schrödinger)
- \(E\) adalah nilai eigen (eigen value) dari energi.
Dengan menyelesaikan Persamaan Schrödinger tidak bergantung waktu (TISE) ini para fisikawan bisa menentukan sifat elektrik, magnetik dan mekanik dari berbagai atom. Sebenarnya ada juga Persamaan Schrödinger bergantung waktu (Time Dependent Schrödinger Equation, TDSE). Sesuai namanya persamaan ini memiliki kebergantungan terhadap variabel waktu. Dengan menyelesaikan Persamaan Schrödinger bergantung waktu (TDSE) ini para fisikawan bisa menentukan sifat optis suatu atom. Persamaan Schrödinger bergantung waktu (TDSE) mungkin akan dibahas lain waktu.
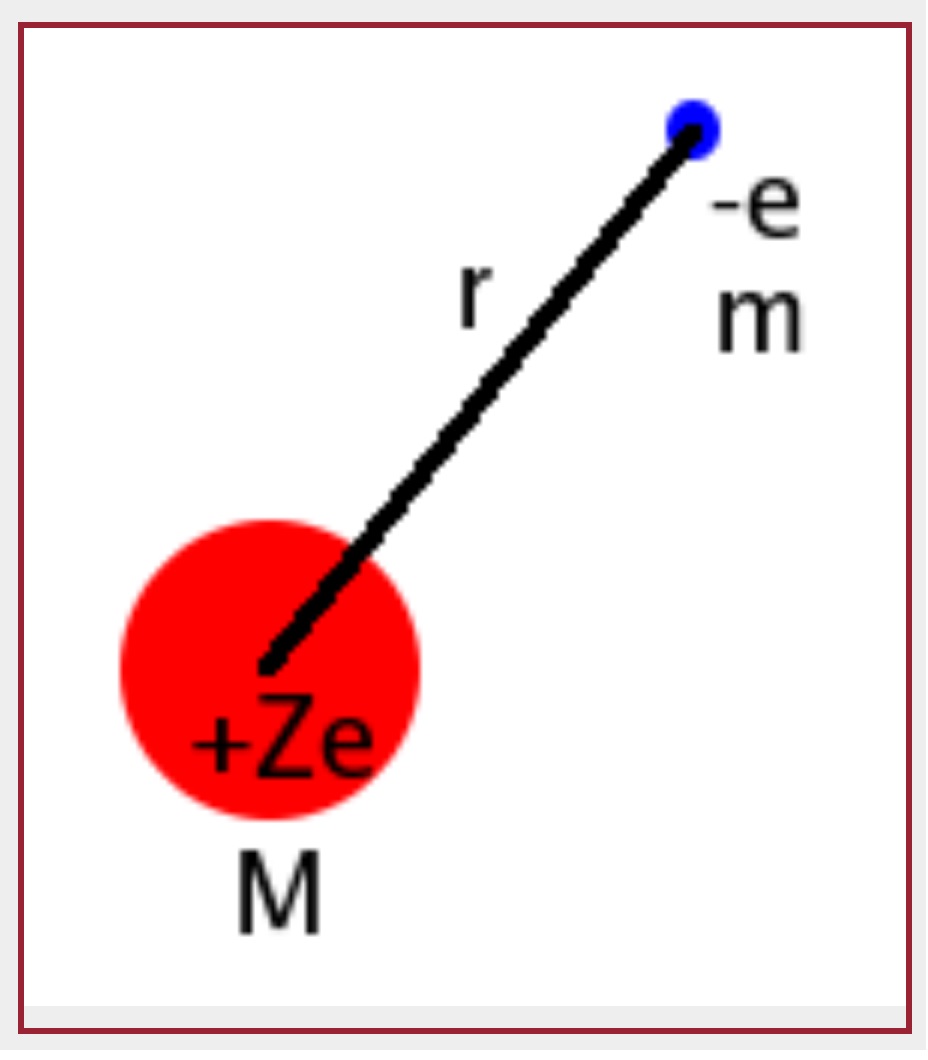
Gambar 1. Pemodelan elektron dan inti pada atom Hidrogen
Ok kembali ke Persamaan Schrödinger tidak bergantung waktu (TISE). Persamaan ini sebenarnya hanya cocok untuk atom - atom berelektron tunggal seperti atom Hidrogen, ion He+, ion Li2+ dsb (untuk atom berelektron banyak fisikawan menggunakan
Alert : Mulai dari sini sebaiknya sobat100 siapkan makanan dan minuman serta banyak buku teks literatur tambahan karena akan banyak formula matematis.
Persamaan yang lebih kompleks dari Persamaan Schrödinger, sebagai contoh Persamaan Köhn-Sham). Jika
\(\hat{H}=\hat{T}+\hat{V}\)
dengan
\(\hat{T}=\frac{\hat{p}^2}{2m}=-\ \frac{\hbar^2}{2m}\ \nabla^2\)
dan
\(V(r)=-\frac{Ze^2}{4\pi\ \epsilon_0\ r}\)
yang mana
- \(Z\ e\) adalah muatan inti (Z = 1 untuk atom Hidrogen, Z = 2 untuk Helium dst)
- \(e\) adalah muatan 1 buah elektron tunggal
- \(\varepsilon_0\) adalah permitivitas vakum
Karena melibatkan interaksi dua massa yaitu massa inti M dan massa elektron m, dalam persamaan ijni didefinisikan massa tereduksi
\(\mu=\frac{m\ M}{m\ +\ M}\)
Atom Hidrogen
sehingga operator Hamilton untuk atom Hidrogen menjadi
\(\hat{H}=-\frac{\hbar^2}{2\mu}\nabla^2-\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\ \cdots \ (2)\)
Substitusikan Persamaan (2) ke Persamaan (1) sehingga dapat ditulis ulang menjadi
\(-\frac{\hbar^2}{2\mu}\nabla^2\ \Psi-\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\ \Psi=E\ \Psi\ \cdots \ (3)\)
Selanjutnya bagi setiap suku dengan \(-\frac{\hbar^2}{2\mu}\) kemudian yang di ruas kanan pindahkan ke ruas kiri maka diperoleh
\(\nabla^2\ \Psi+\frac{2\mu}{\hbar^2}[E+\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}]\ \Psi=0\ \cdots \ (4)\)
untuk koordinat bola
\(\nabla^2=\frac{1}{r^2}\frac{\partial}{\partial r}\left(r^2\frac{\partial\psi}{\partial r}\right)+\frac{1}{r^2\sin\theta}\frac{\partial}{\partial\theta}\left(\sin\theta\frac{\partial\psi}{\partial\theta}\right)+\frac{1}{r^2\sin^2\theta}\frac{\partial^2\psi}{\partial\phi^2}\ \cdots \ (5)\)
Substitusi Persamaan (5) ke Persamaan (4) sehingga diperoleh menjadi
\(\frac{1}{r^2}\frac{\partial}{\partial r}\left(r^2\frac{\partial\Psi}{\partial r}\right)+\frac{1}{r^2\sin\theta}\frac{\partial}{\partial\theta}\left(\sin\theta\frac{\partial\Psi}{\partial\theta}\right)+\frac{1}{r^2\sin^2\theta}\frac{\partial^2\Psi}{\partial\phi^2}+\frac{2\mu}{\hbar^2}\left(E+\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\right)\Psi=0\ \cdots\ (6)\)
Persamaan (6) dinyatakan dalam bentuk Persamaan Diferensial orde 2. Untuk memahaminya disarankan sobat100 sudah mempelajari Kalkulus Lanjut agar tidak roaming dalam pembahasan berikutnya. Sebagai bahan bacaan silakan sobat100 pelajari formulanya dalam buku Mathematical Methods in The Physical Sciences.[1]
Dalam menyelesaikan Persamaan (6) biasanya menggunakan Metode Separasi Variabel yang mana
\(\Psi(r,\theta,\phi)=R(r)\cdot Y(\theta,\phi)\ \cdots\ (7)\)
Catatan : Mulai dari sini sobat100 perlu memahami bahwa
\(r\ {\rm atau}\ R \Longrightarrow \rm menyatakan\ bagian\ radial\\ Y\ {\rm atau}\ y \Longrightarrow \rm menyatakan\ bagian\ anguler \ atau \ sudut\\ \theta\ {\rm atau}\ \Theta \Longrightarrow \rm menyatakan\ bagian\ polar \ atau \ kutub\\ \phi\ {\rm atau}\ \Phi \Longrightarrow \rm menyatakan\ bagian\ azimuth\)
Substitusikan Persamaan (7) ke Persamaan (6) sehingga menjadi
\(\frac{Y}{r^2}\frac{\rm d}{{\rm d}r}\left(r^2\frac{{\rm d}R}{{\rm d}r}\right)+\frac{R}{r^2\sin\theta}\frac{\partial}{\partial\theta}\left(\sin\theta\frac{\partial Y}{\partial\theta}\right)+\frac{R}{r^2\sin^2\theta}\frac{\partial^2Y}{\partial\phi^2}+\frac{2\mu}{\hbar^2}\left(E+\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\right)R\ Y=0\ \cdots\ (8)\)
Setiap suku kalikan dengan r2 dan bagi dengan R Y maka kita peroleh
\(\bbox[pink]{\frac{1}{R}\frac{\rm d}{{\rm d}r}\left(r^2\frac{{\rm d}R}{{\rm d}r}\right)}+\bbox[lightblue]{\frac{1}{Y\sin\theta}\frac{\partial}{\partial\theta}\left(\sin\theta\frac{\partial Y}{\partial\theta}\right)+\frac{1}{Y\sin^2\theta}\frac{\partial^2Y}{\partial\phi^2}}+\bbox[pink]{\frac{2\mu\ r^2}{\hbar^2}\left(E+\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\right)}=0\ \cdots \ (9)\)
Suku ke-1 dan ke-4 adalah bagian yang bergantung terhadap nilai r, sehingga didefinisikan sebagai bagian radial
\(\bbox[pink]{\frac{\rm d}{{\rm d}r}\left(r^2\frac{{\rm d}R}{{\rm d}r}\right)+\frac{2\mu\ r^2}{\hbar^2}\left(E+\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\right)R}-A\ R=0\ \cdots \ (10)\)
Sementara suku ke-2 dan ke-3 adalah bagian yang bergantung terhadap sudut, sehingga didefinisikan sebagai bagian sudut
\(\bbox[lightblue]{\frac{1}{\sin\theta}\frac{\partial}{\partial\theta}\left(\sin\theta\frac{\partial Y}{\partial\theta}\right)+\frac{1}{\sin^2\theta}\frac{\partial^2Y}{\partial\phi^2}}+A\ Y=0\ \cdots \ (11)\)
yang mana A adalah konstanta yang perlu dicari nilainya nanti. Untuk menyelesaikan Persamaan (11) kita perlu membedakan bagian kutub (polar) dan bagian azimut. Kembali digunakan Metode Separasi Variabel yang mana
\(Y(\theta,\phi)=\Theta(\theta)\cdot\Phi(\phi)\ \cdots \ (12)\)
Substitusikan Persamaan (12) ke Persamaan (11) diperoleh
\(\frac{\Phi}{\sin\theta}\frac{\rm d}{{\rm d}\theta}\left(\sin\theta\frac{{\rm d}\Theta}{{\rm d}\theta}\right)+\frac{\Theta}{\sin^2\theta}\frac{{\rm d}^2\Phi}{{\rm d}\phi^2}+A\ \Phi\ \Theta=0\ \cdots\ (13)\)
Setiap suku kalikan dengan sin2 θ dan bagi dengan θ Φ maka kita peroleh
\(\bbox[lightgreen]{\frac{\sin\theta}{\Theta}\frac{\rm d}{{\rm d}\theta}\left(\sin\theta\frac{{\rm d}\Theta}{{\rm d}\theta}\right)}+\bbox[yellow]{\frac{1}{\Phi}\frac{{\rm d}^2\Phi}{{\rm d}\phi^2}}+\bbox[lightgreen]{A\sin^2\theta}=0\ \cdots \ (14)\)
Suku ke-1 dan ke-3 adalah bagian yang bergantung nilai θ, sehingga didefinisikan sebagai bagian kutub (polar)
\(\bbox[lightgreen]{\frac{\sin\theta}{\Theta}\frac{\rm d}{{\rm d}\theta}\left(\sin\theta\frac{{\rm d}\Theta}{{\rm d}\theta}\right)+A\sin^2\theta}-B=0\ \cdots\ (15)\)
Suku ke-2 adalah bagian yang bergantung nilai Φ, sehingga didefinisikan sebagai bagian azimut
\(\bbox[yellow]{\frac{1}{\Phi}\frac{{\rm d}^2\Phi}{{\rm d}\phi^2}}+B=0\ \cdots\ (16)\)
yang mana B adalah konstanta yang perlu dicari nilainya nanti. Setiap suku di Persamaan (16) kalikan dengan Φ sehingga diperoleh
\(\frac{{\rm d}^2\Phi}{{\rm d}\phi^2}+B\ \Phi=0\ \cdots \ (17)\)
Solusi dari persamaan (17) adalah
\(\Phi(\phi)=c_1\ {\rm e}^{{\rm i}\ m\ \phi}+c_2\ {\rm e}^{-{\rm i}\ m\ \phi}\ \cdots \ (18)\)
yang mana B = m2. Sudut Φ adalah azimuth. Jika Sobat100 menganggap atom sebagai bola dunia, maka Φ adalah bujur posisi elektron. Selama tidak ada alasan eksternal untuk melakukan sebaliknya, kita dapat memilih "meridian Greenwich" atom dengan cara yang nyaman secara matematis dengan menyetel c2 = 0.
Catatan : Persamaan (17) memiliki bentuk yang mirip saat kita mempelajari Gerak Harmonik Sederhana Pegas di bangku SMA. Saat pegas yang memiliki konstanta pegas k kemudian ditekan sejauh x lalu dilepaskan, maka pegas akan bergerak bolak - balik di sekitar titik setimbangnya.
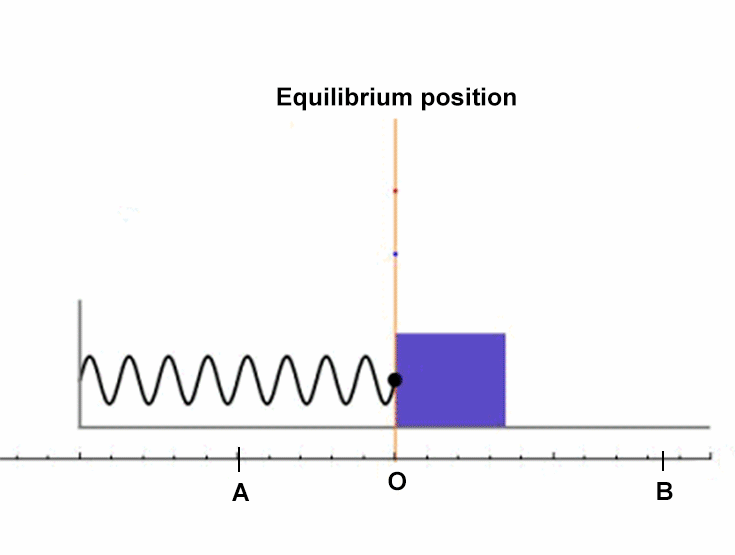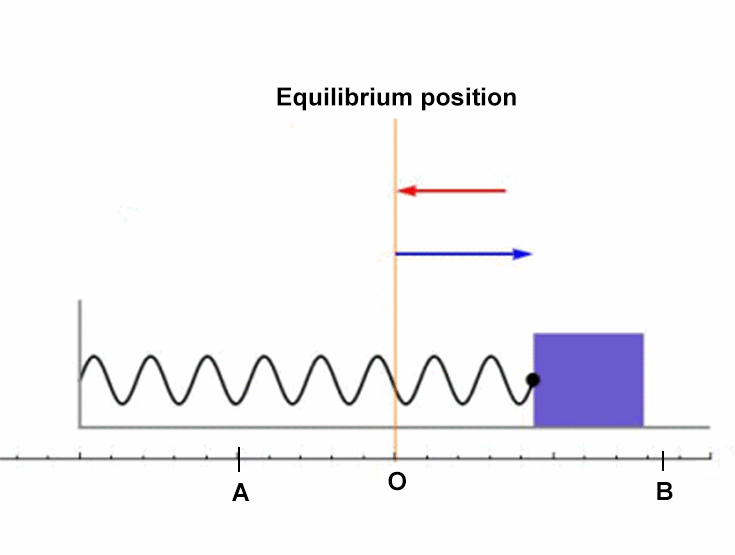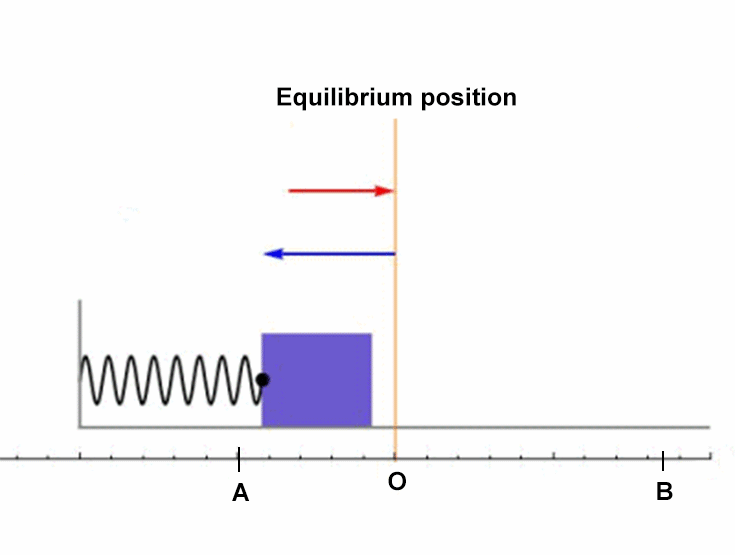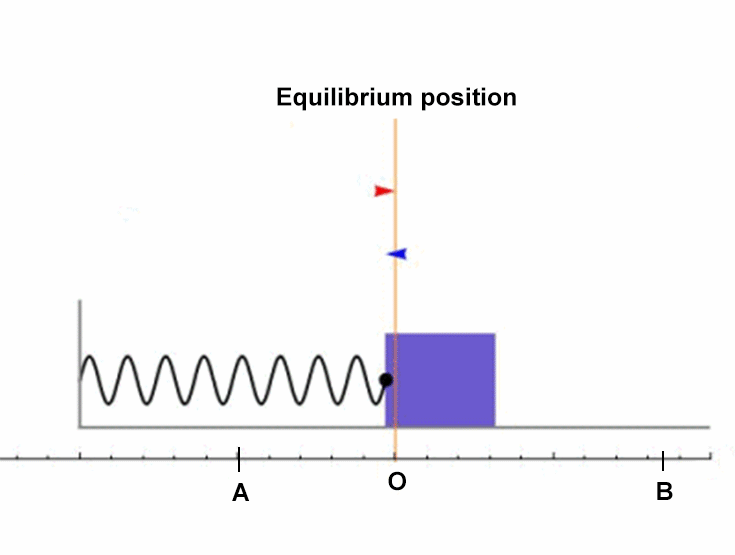
Gambar 2. Ilustrasi Gerak Harmonik Sederhana sistem pegas
Persamaan gerak pegas biasanya diformulasikan sesuai dengan Hukum II Newton
\(\Sigma F = m\ . \ a\)
Berdasar hukum Hooke, gaya pegas nilai nya bergantung pada konstanta pegas k dan perubahan panjang pegas x ( \(F_P=-\ k\ . \ x\) ). Sobat100 ingat ya bahwa percepatan adalah turunan kedua dari fungsi posisi. Sehingga persamaan gerak pegas bisa kita tuliskan sebagai
\(-\ k\ . \ x= m \ \frac{{\rm {d}^2} x}{{\rm d} t^2}\)
Seperti yang sudah kita pelajari saat belajar Fisika di SMA, solusi dari persamaan gerak pegas di atas adalah
\(x=A\ \sin \omega \ t\)
yang mana
\(\omega^2=\frac{k}{m}\)
Kembali ke Persamaan (17), jika di SMA kita dikenalkan solusinya dalam bentuk bisa fungsi sinus atau fungsi cosinus. Namun kali ini di Persamaan (17) dinyatakan dalam bentuk eksponensial. Ingat
\(\ \ e^{i\theta} = \cos \theta \ + \ i \sin\theta \\ e^{-i\theta} = \cos\theta\ - \ i \sin\theta\)
atau
\(\:\cos \theta=\frac{1}{2}(e^{i\theta}+e^{-i\theta})\\ \ \sin \theta=\frac{1}{2}(e^{i\theta}-e^{-i\theta})\)
Kembali ke Persamaan (18), perhatikan bahwa m harus bilangan bulat. Jika tidak, nilai fungsi gelombang azimuth akan berbeda untuk = 0o dan = 360o. Dalam terminologi kuantum, m disebut bilangan kuantum magnetik karena membatasi nilai yang mungkin dari fungsi gelombang (dan karenanya dari yang dapat diamati) ke kelipatan bilangan bulat (kuanta) dari unit dasar.
Jadi, bagian azimuth dari fungsi gelombang Persamaan (18) adalah
\(\Phi_m(\phi)=c_1\ {\rm e}^{{\rm i}\ m\ \phi}\ \cdots\ (19)\)
karena B = m2 maka Persamaan (15) kita tulis ulang menjadi
\(\frac{\sin\theta}{\Theta}\frac{\rm d}{{\rm d}\theta}\left(\sin\theta\frac{{\rm d}\Theta}{{\rm d}\theta}\right)+A\sin^2\theta-m^2=0\ \cdots\ (20)\)
setiap suku bagi dengan sin2 θ dan kalikan dengan θ maka diperoleh
\(\frac{1}{\sin\theta}\frac{\rm d}{{\rm d}\theta}\left(\sin\theta\frac{{\rm d}\Theta}{{\rm d}\theta}\right)+\left(A-\frac{m^2}{\sin^2\theta}\right)\Theta=0\ \cdots \ (21)\)
Untuk menyelesaikan Persamaan (21) digunakan definisi sebagai berikut
\(P(\cos\theta):=\Theta(\theta)\ \cdots \ (22)\\ \ \ \ \ \ \ \ \ \ \ \ \ x:=\cos\theta\ \cdots \ (23)\)
Gunakan juga bentuk diferensial
\(\frac{\rm d}{{\rm d}\theta}=\frac{{\rm d}x}{{\rm d}\theta}\frac{\rm d}{{\rm d}x}=-\sin\theta\frac{\rm d}{{\rm d}x}\ \cdots \ (24)\)
Substitusi Persamaan (22), (23) dan (24) ke Persamaan (21) maka kita peroleh
\(\frac{1}{\sin\theta}(-\sin\theta)\frac{\rm d}{{\rm d}x}\left(\sin\theta(-\sin\theta)\frac{{\rm d}P}{{\rm d}x}\right)+\left(A-\frac{m^2}{\sin^2\theta}\right)P=0\ \cdots \ (25)\)
atau kita sederhanakan menjadi
\(\frac{\rm d}{{\rm d}x}\left(\sin^2\theta\frac{{\rm d}P}{{\rm d}x}\right)+\left(A-\frac{m^2}{\sin^2\theta}\right)P=0\ \cdots \ (26)\)
karena \(\sin^2\theta+\cos^2\theta=1\) maka \(\sin^2\theta=1-\cos^2\theta=1-x^2\) sehingga Persamaan (26) menjadi
\(\frac{\rm d}{{\rm d}x}\left((1-x^2)\frac{{\rm d}P}{{\rm d}x}\right)+\left(A-\frac{m^2}{1-x^2}\right)P=0\ \cdots \ (27)\)
Selesaikan bentuk diferensial pada suku ke-1 pada Persamaan (27) maka kita peroleh
\((1-x^2)\frac{{\rm d}^2P}{{\rm d}x^2}-2x\frac{{\rm d}P}{{\rm d}x}+\left(A-\frac{m^2}{1-x^2}\right)P=0\ \cdots \ (28)\)
Solusi Persamaan (28) adalah Polinom Legendre
yang mana koefisiennya adalah
\(a_{n+2}=\frac{(n\ +\ m)\ (n\ +\ m\ +\ 1)\ -\ A}{(n\ + \ 1)\ (n\ +\ 2)}\ a_n\)
Ini berarti ada dua deret pangkat (masing-masing untuk suku genap dan ganjil) dan koefisien suku yang lebih tinggi dapat dihitung secara rekursif jika koefisien pertama dari setiap deret, a0 dan a1, diketahui. Dalam rumus rekursi, A dan m adalah konstanta yang kita miliki dari bagian sebelumnya dari strategi solusi, sedangkan n adalah variabel indeks dari dua deret pangkat.
Solusi deret hanya berguna jika deret tersebut konvergen sehingga dapat dipotong segera setelah solusi cukup akurat. Untuk rumus rekursi di atas, deret konvergen jika \(A=l\ (l+1)\) di mana \(l\) adalah bilangan bulat. Koefisien akar dari dua deret, a0 dan a1, dipilih tergantung pada nilai tertentu dari \(l\) untuk memastikan hanya deret konvergen yang bertahan. Beberapa fungsi Legendre pertama adalah:
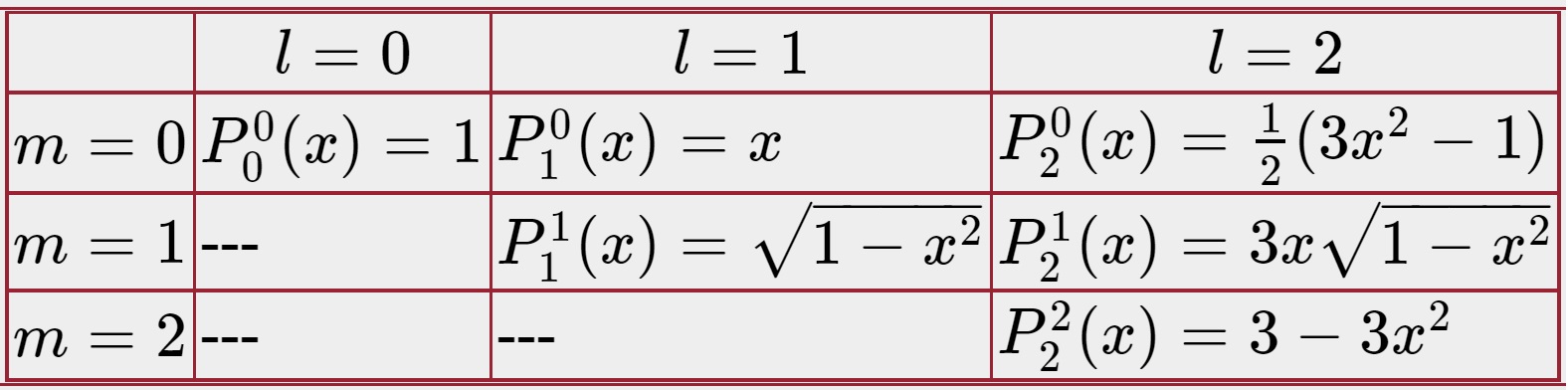
Nilai \(l\) membatasi pilihan m; nilai m harus memiliki nilai antara \(-\ l\) dan \(l\). Sejauh menyangkut bagian kutub, solusi ± m adalah setara, tetapi tanda m membuat perbedaan pada bagian azimut seperti yang terlihat di atas. Selanjutnya substitusi Persamaan (23) maka
- \(P_0^0(\cos\theta)=1\)
- \(P_1^0(\cos\theta)=\cos\theta\)
- \(P_2^0(\cos\theta)=\frac{1}{2}(3\cos^2 \theta-1)\)
- \(P_1^1(\cos\theta)=\sqrt{1-\cos^2 \theta}=\sin \theta\)
- \(P_2^1(\cos\theta)=3\cos\theta\ \sqrt{1-\cos^2 \theta}=3\cos\theta\ \sin\theta\)
- \(P_2^2(\cos\theta)=3-3\cos^2 \theta=3 \sin^2 \theta\)
Karena \(A=l\ (l+1)\) maka Persamaan (10) kita tulis ulang menjadi
\(\frac{\rm d}{{\rm d}r}\left(r^2\frac{{\rm d}R}{{\rm d}r}\right)+\frac{2\mu\ r^2}{\hbar^2}\left(E+\frac{Ze^2}{4\pi\ \epsilon_0\ r}\right)R-l\ (l+1)R=0\ \cdots \ (29)\)
Selesaikan bentuk diferensial pada suku ke-1 pada Persamaan (29) maka kita peroleh
\(r^2\frac{{\rm d}^2R}{{\rm d}r^2}+2r\frac{{\rm d}R}{{\rm d}r}+\frac{2\mu\ r^2}{\hbar^2}\left(E+\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}\right)R-l\ (l+1)R=0\ \cdots \ (30)\)
Setiap suku pada Persamaan (30) bagi dengan r2 maka kita peroleh
\(\frac{{\rm d}^2R}{{\rm d}r^2}+\bbox[lightblue]{\frac{2}{r}\frac{{\rm d}R}{{\rm d}r}}+\left[\ \frac{2\mu}{\hbar^2}\left(E+\bbox[lightblue]{\frac{Z\ e^2}{4\pi\ \epsilon_0\ r}}\right)\bbox[lightblue]{-\frac{l\ \left(l+1\right)}{r^2}}\ \right]R=0\ \cdots\ (31)\)
Kita tidak bisa menyelesaikan Persamaan (31) tapi kita bisa dekati dengan mengambil saat nilai r sangat besar sekali. Karena suku yang berwarna biru bentuk nya adalah per r maka saat nilai r sangat besar sekali nilainya menjadi mendekati nol. Sehingga saat nilai r sangat besar sekali Persamaan (31) menjadi
\(\frac{{\rm d}^2R_{\infty}}{{\rm d}r^2}+\frac{2\mu\ E}{\hbar^2}R_{\infty}=0\ \cdots \ (32)\)
Solusi Persamaan (32) adalah
\(R_{\infty}=c_3\exp{\left({\rm i}\ \sqrt{\frac{2\ \mu\ E}{\hbar^2}}r\right)}+c_4\exp{\left(-\ {\rm i}\ \sqrt{\frac{2\ \mu\ E}{\hbar^2}}r\right)}\ \cdots \ (33)\)
Masuk akal untuk menggunakan energi potensial sebagai titik nol energi elektron bebas, yaitu dalam kasus asimtotik ini, E → 0 untuk elektron yang jauh dari nukleus, karena secara praktis bebas. Karena keberadaan muatan positif dalam inti menstabilkan atom, kita harus mencari solusi di mana E menjadi negatif ketika elektron mendekati inti. Kedua kondisi ini terpenuhi jika kita memilih c4 = 0 dan menggunakan fakta bahwa E < 0 untuk menghilangkan unit imajiner.
Maka solusi asimtotiknya adalah
\(R_{\infty}=c_3\exp{-\left(\sqrt{-\frac{2\ \mu\ E}{\hbar^2}}r\right)}\ \cdots \ (34)\)
Detail yang lebih dekat dengan nukleus diperluas dalam deret pangkat
Ini menghasilkan serangkaian pangkat r yang koefisiennya harus nol agar sesuai dengan persamaan diferensial pada Persamaan (32). Dari itu, rumus rekursi diturunkan untuk bq, dan persyaratan deret untuk konvergen menghasilkan bilangan kuantum lain, n.
Ini menghasilkan solusi radial
\(R_{n,l}(r)=R_{\infty}(r)\ b_0\ \exp{\left(\frac{\mu\ Z\ e^2\ r}{2\pi\ \epsilon_0\ \hbar^2\ n}\right)}\ \cdots \ (36)\)
di mana koefisien b0 mengandung ketergantungan-\(l\). Pada saat yang sama, solusi bagian radial juga memperbaiki tingkat energi yang mungkin dengan menghubungkannya ke bilangan kuantum n. Tingkat energi atom mirip hidrogen diberikan oleh
\(E_n=-\frac{\mu\ Z^2\ e^4}{8\ {\epsilon_0}^2\ h^2\ n^2}\ \cdots \ (37)\)
Solusi lengkap persamaan Schrödinger dari atom mirip hidrogen, menurut pendekatan pemisahan yang diambil:
\(\Psi(r,\theta,\phi)=R(r)\ \Theta(\theta)\ \Phi(\phi)\\ \Psi(r,\theta,\phi)=N\ R_{n,l}(r)\ P_l^m(\cos\theta)\ {\rm e}^{{\rm i}m\phi}\ \cdots \ (38)\)
dimana N diperoleh dengan normalisasi dan termasuk koefisien dari setiap solusi parsial.

Gambar 3. Ilustrasi Fungsi Gelombang atom Hidrogen untuk setiap keadaan n, \(\ell\) , m.[2]
Untuk n = 1 dan 2.
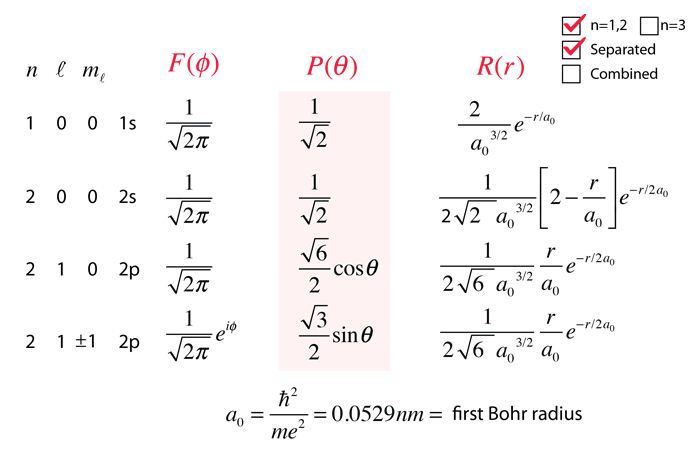
atau

Sebagai bahan diskusi kita ambil fungsi gelombang untuk 2pX
\(\Psi_{2p_\rm X}=\frac{r}{8\ \sqrt{\pi} \ {a_0}^\frac{5}{2}}\ e^{-\frac{r}{2\ a_0}}\ \sin \theta \times e^{- i \ \phi}\ \cdots \ (39)\)
Model Atom Bohr
Dalam Tabel di atas, solusi dari persamaan Schrödinger dapat dinyatakan dalam variabel \(a_0\), yang merupakan jari - jari atom Bohr
Bagaimana mendapatkan nilainya?
Sobat100 cek kembali Gambar ini

Pergerakan elektron mengelilingi inti juga mengikuti Hukum II Newton
\(\Sigma F = m\ . \ a\ \cdots (40)\)
Berdasar Hukum Coulomb, gaya interaksi antara elektron dan inti dinyatakan sebagai
\(F=\frac{1}{4\pi\ \varepsilon_0}\ \frac{Z\ e^2}{r^2}\ \cdots (41)\)
lintasan elektron diasumsikan seperti bentuk lingkaran yang berpusat di inti atom sehingga elektron senantiasa merasakan percepatan sentripetal
\(a_{\rm S}=\frac{v^2}{r}\ \cdots (42)\)
Substitusikan Persamaan (41) dan Persamaan (42) ke Persamaan (40) diperoleh
\(\frac{1}{4\pi\ \epsilon_{0}}\ . \ \frac{Z\ .\ e^{2}}{r^{2}} = \frac{m\ v^{2}}{r}\)
atau
\(v^{2} = \frac{1}{4\pi\ \epsilon_{0}}\ .\ \frac{Z\ e^{2}}{m\ r}\ \cdots\ (43)\)
Menurut Model atom Bohr, besar momentum sudut elektron adalah
\(L=m\ v\ r\\ \ \ \ \ \ \ \ \ m\ v\ r=n\ \hbar\)
atau
\(v = \frac{n\ ħ}{m\ r}\ \cdots \ (44)\)
Substitusi Persamaan (44) ke Persamaan (43) diperoleh
\((\frac{n\ ħ}{m\ r})^{2} = \frac{1}{4\pi\ \epsilon_{0}}\ . \ \frac{z\ e^{2}}{m\ r}\)
Selanjutnya didefinisikan jari - jari orbit elektron pada kulit ke - n adalah
\(r = \frac{4\pi\ \epsilon_{0}\ n^{2}\ ħ^{2}}{m\ Z\ e^{2}}\ \cdots\ (45)\)
untuk kulit ke-1 (n = 1) atom Hidrogen (Z = 1) maka r1 didefinisikan sebagai jari - jari atom Bohr \(a_0\)
\(a_0 = \frac{4\pi\ \epsilon_{0}\ ħ^{2}}{m\ e^{2}}\ \cdots\ (46)\)
untuk elektron masukkan data sebagai berikut
- massa elektron, m = 9,11 × 10-31 kg
- muatan elektron, e = 1,602 × 10-19 C
dan
- konstanta Planck tereduksi, ℏ = 1,054 5718 × 10-34 m2 kg / s
- permitivitas vakum, ε0 = 8.854 187 817 × 10−12 F·m−1
didapatkan \(a_0\) = 5,291 772 1067 × 10-11 m
Atom Karbon
OK, itu tadi atom Hidrogen, lumayan panjang bukan? Bagaimana dengan atom yang lain. Sudah disebutkan bahwa persamaan Schrödinger sebenarnya hanya cocok untuk atom atau ion yang berelektron tunggal saja.
Namun beberapa fisikawan masih menggunakan persamaan Schrödinger untuk mengerjakan fungsi gelombang pada atom - atom yang berlektron lebih dari 1 dengan beberapa faktor koreksi.
Perlu Sobat100 pahami sebelumnya, atom Karbon sering kali menjadi objek penelitian oleh para ilmuwan. Ada beberapa alasan :
- Karbon lumayan banyak ditemukan secara mudah
- Memiliki elektron valensi 4 memungkinkan karbon berada dalam banyak orbital
Untuk memahami orbital atom Karbon, Sobat100 perlu pelajari dulu konfigurasi elektronnya. Karbon memiliki 6 elektron sehingga konfigurasinya adalah 1s2 2s2 2p2. Elektron valensi atom Karbon netral memiliki bilangan kuantum n = 2 , L = 1 , m = 0 , s = + ½. Sementara untuk ion karbon memiliki bilangan kuantum n = 2 , L = 1 , m = - 1 , s = + ½
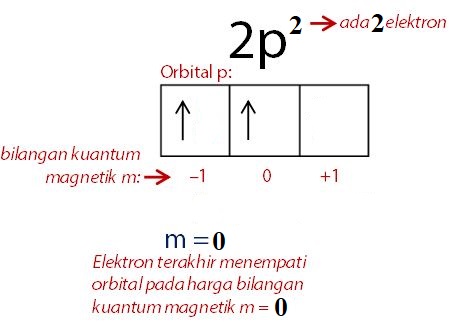
Berikut ini fungsi gelombang untuk atom Karbon pada orbital 2pX
\(\Psi_{2p_\rm X}=\frac{r}{8\ \sqrt{\pi} \ }\ (\frac{Z}{a_0})^\frac{5}{2}\ e^{-\frac{Z\ r}{2\ a_0}}\ \sin \theta \times e^{- i \ \phi}\ \cdots \ (47)\)
Perbedaan antara Persaamaan (39) dan Persamaan (47) adalah adanya variabel Z (yang menyatakan jumlah proton dalam inti). Karena adanya faktor koreksi interaksi antar elektron khusus atom Karbon masukkan nilai Z = 3,25.
Adapun bentuk Probabilitas dari Persamaan (47) adalah
\(|\Psi_{2p_\rm X}|^2=\frac{r^2}{64\ \pi \ }\ (\frac{Z}{a_0})^5\ e^{-\frac{Z\ r}{ a_0}}\ \sin^2 \theta \times e^{ \phi}\ \cdots \ (48)\)
yang mana untuk bagian radial nya bisa digambarkan sebagai berikut
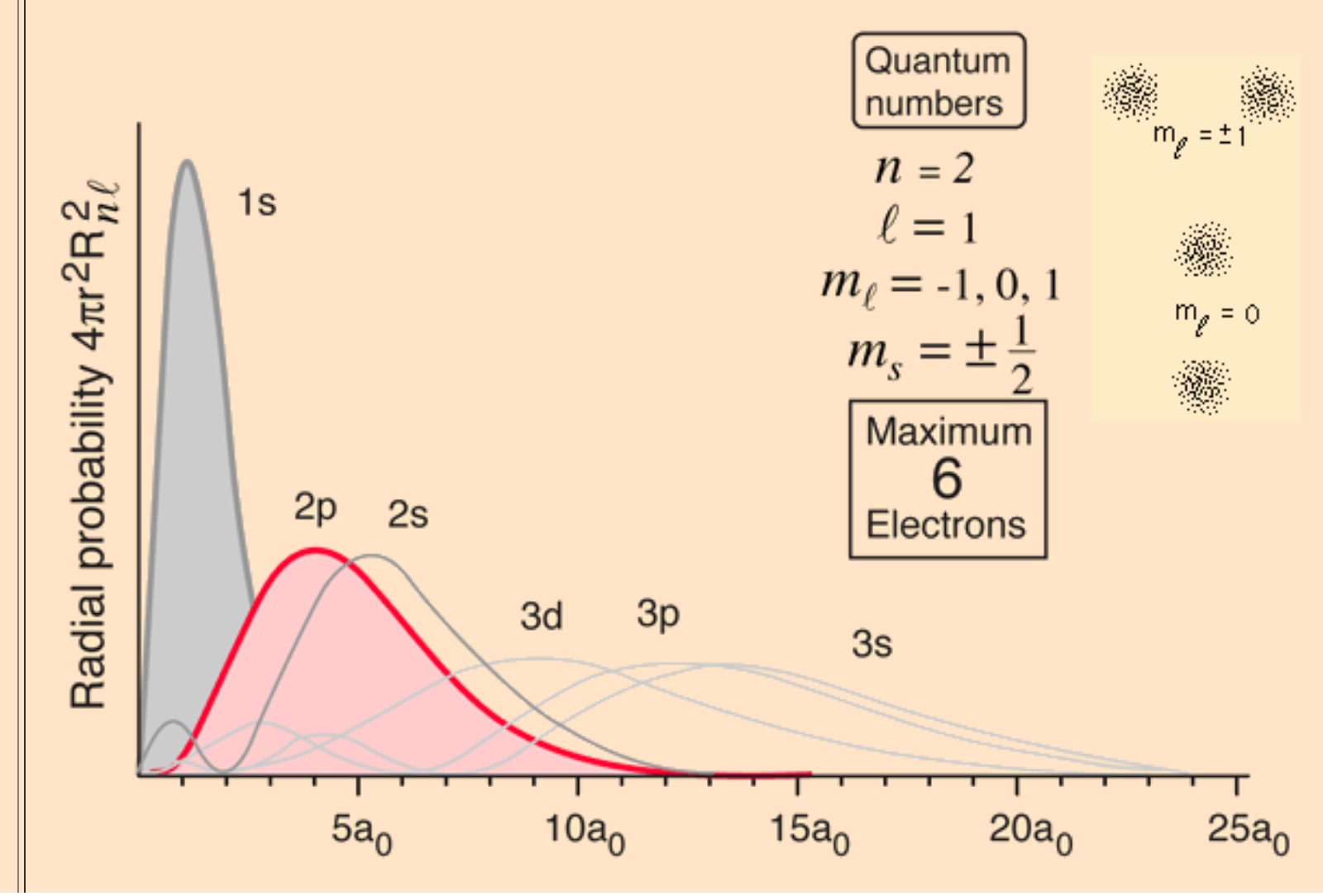
Gambar 4. Probalitas Radial 2p[3]
Persamaan (47) bisa kita kerjakan secara numerik. Di sini ditampilkan tabel 50 x 50 nilai untuk bagian anguler nya
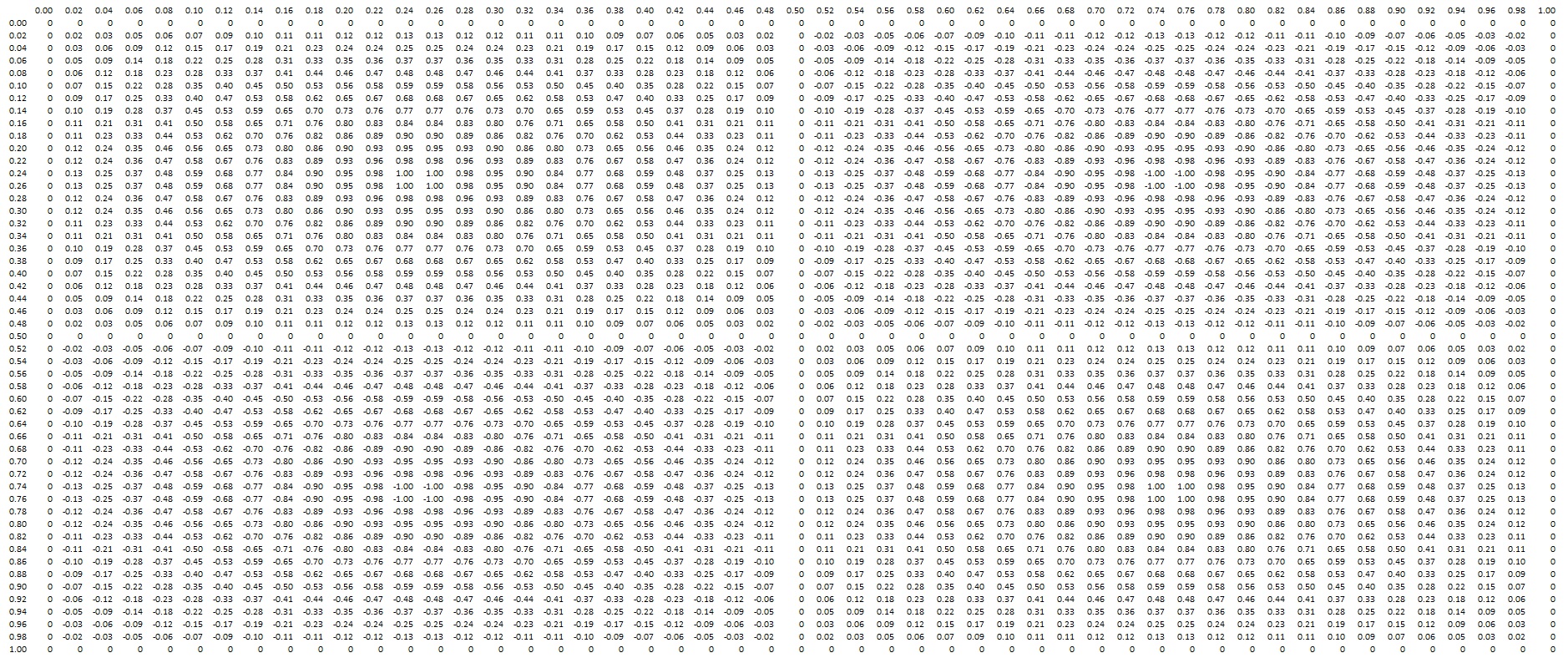
Apabila digambar menggunakan Microsoft Excel kira-kira bentuk nya seperti ini

Yang mana bentuk nya apabila dilihat dari atas menjadi

Persamaan (48) bisa kita kerjakan secara numerik. Di sini ditampilkan tabel 50 x 50 nilai untuk bagian anguler nya

Apabila digambar menggunakan Microsoft Excel kira-kira bentuk nya seperti ini
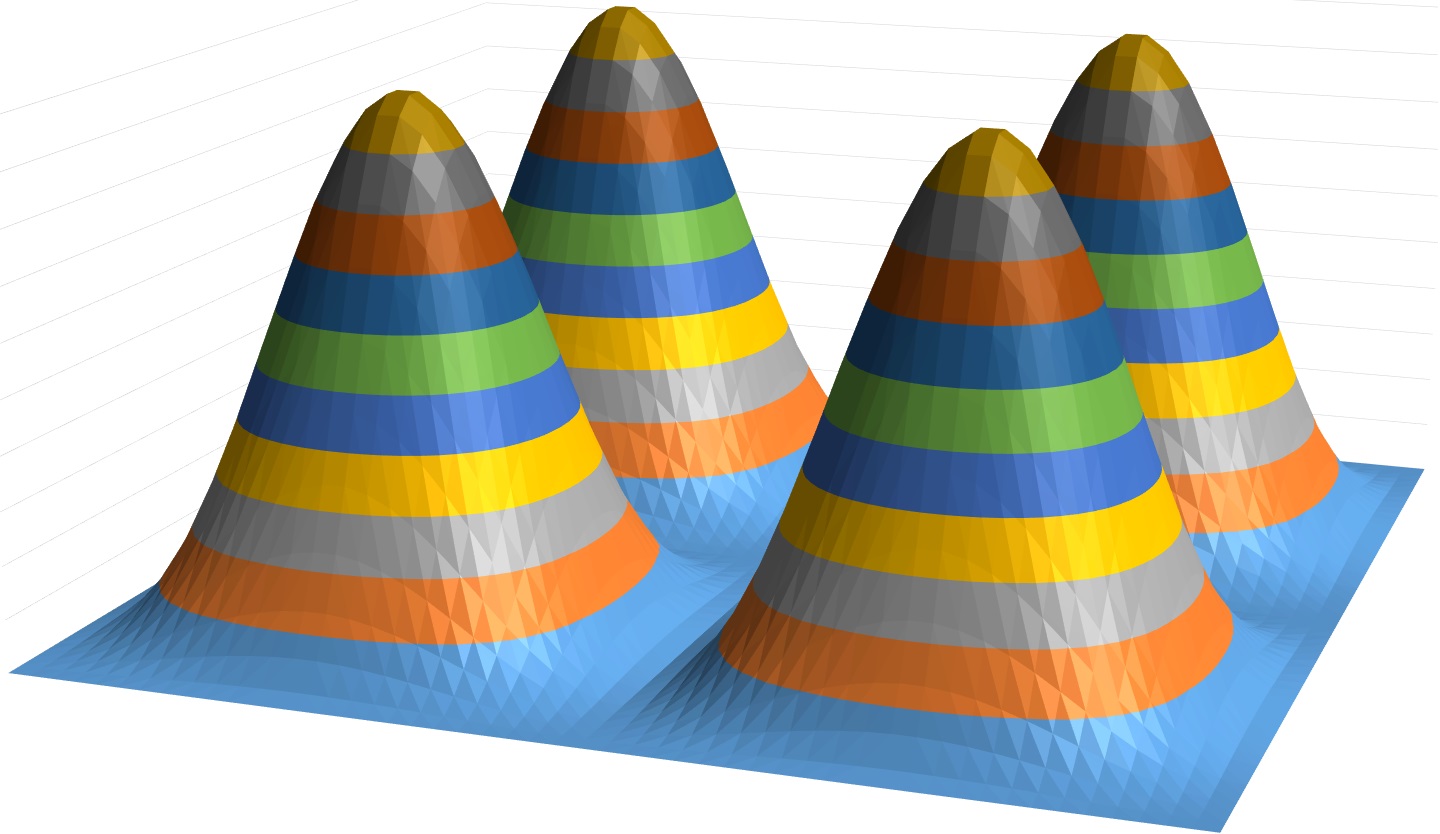
Yang mana bentuk nya apabila dilihat dari atas menjadi

Sehingga plot untuk orbital 2pX adalah
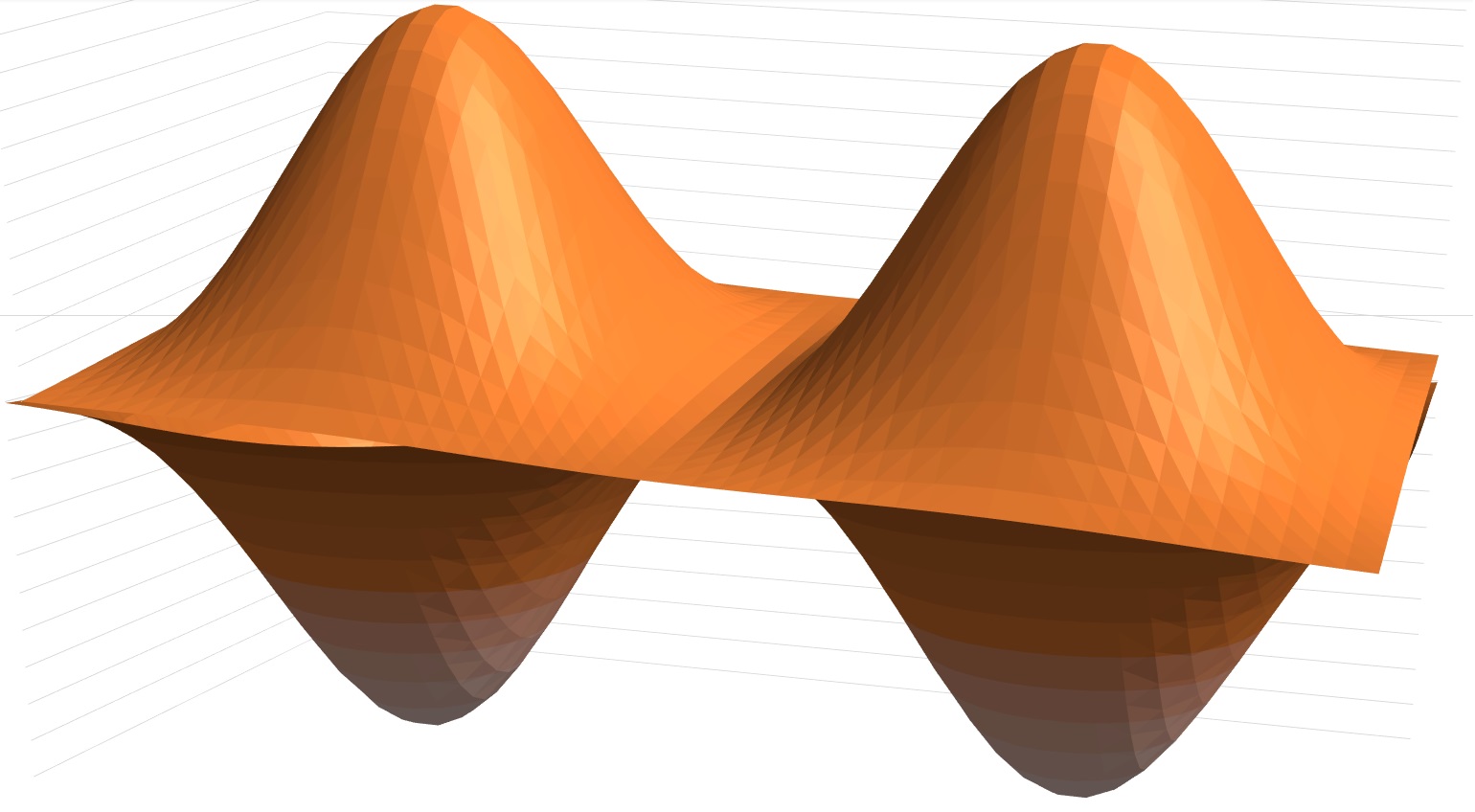
Well, itu tadi penjelasan fungsi gelombang atom dalam fisika Kuantum. Adapun mempelajari fungsi gelombang atom merupakan pondasi dasar untuk hal yang lebih lanjut yaitu sintesa senyawa kompleks. Dalam sintesa material baru seorang ilmuwan harus memahami hal yang mendasar ini.
Semoga bermanfaat.
Daftar Pustaka
- ^ Mary L. Boas. 2006. Mathematical Methods in The Physical Sciences (2nd & 3rd EDITION). John Wiley & Sons, Inc.
- ^ Forinash, Kyle. Hydrogen W Simulation. Indiana University Southeast. Retrieved on 2008-12-18. Tokita, Sumio; Sugiyama, Takao; Noguchi, Fumio; Fujii, Hidehiko; Kobayashi, Hidehiko (2006). "An Attempt to Construct an Isosurface Having Symmetry Elements". Journal of Computer Chemistry, Japan 5 (3): 159–164.
- ^ Hyperphycics. 2016. Department of Physics and Astronomy, Georgia State University. http://hyperphysics.phy-astr.gsu.edu






Komentar berhasil disembunyikan.