Hallo Sobat100! 👋
Tim100 kembali lagi dengan pembahasan soal Kimia SMA yang pastinya bisa bantu kamu memahami konsep-konsep penting dengan lebih mudah dan jelas. Yuk belajar bareng SeratusInstitute.com dan tingkatkan kemampuanmu mengerjakan soal-soal stoikiometri! 🔥📘
Stoikiometri adalah salah satu materi dasar dalam kimia yang nggak boleh kamu lewatkan. Di sini, kita belajar hubungan antara massa, mol, koefisien reaksi, sampai volume gas.
Pada artikel kali ini, kita akan membahas soal tentang reaksi FeS + HCl dan bagaimana cara menentukan kadar FeS yang benar-benar bereaksi berdasarkan gas yang dihasilkan.

1. Reaksi Kimia yang Diberikan
Reaksi antara besi(II) sulfida (FeS) dan asam klorida (HCl) adalah:
FeS + 2HCl → FeCl₂ + H₂S
Persamaan ini menunjukkan bahwa setiap 1 mol FeS akan menghasilkan 1 mol H₂S.
Perbandingan 1:1 ini sangat penting untuk perhitungan kita nanti.
2. Data Yang Diketahui
Dari soal, informasi yang diberikan adalah:
-
Massa FeS awal: 44 gram
-
Volume gas H₂S yang dihasilkan: 8 liter
-
Pada kondisi tersebut: 1 mol gas = 20 liter
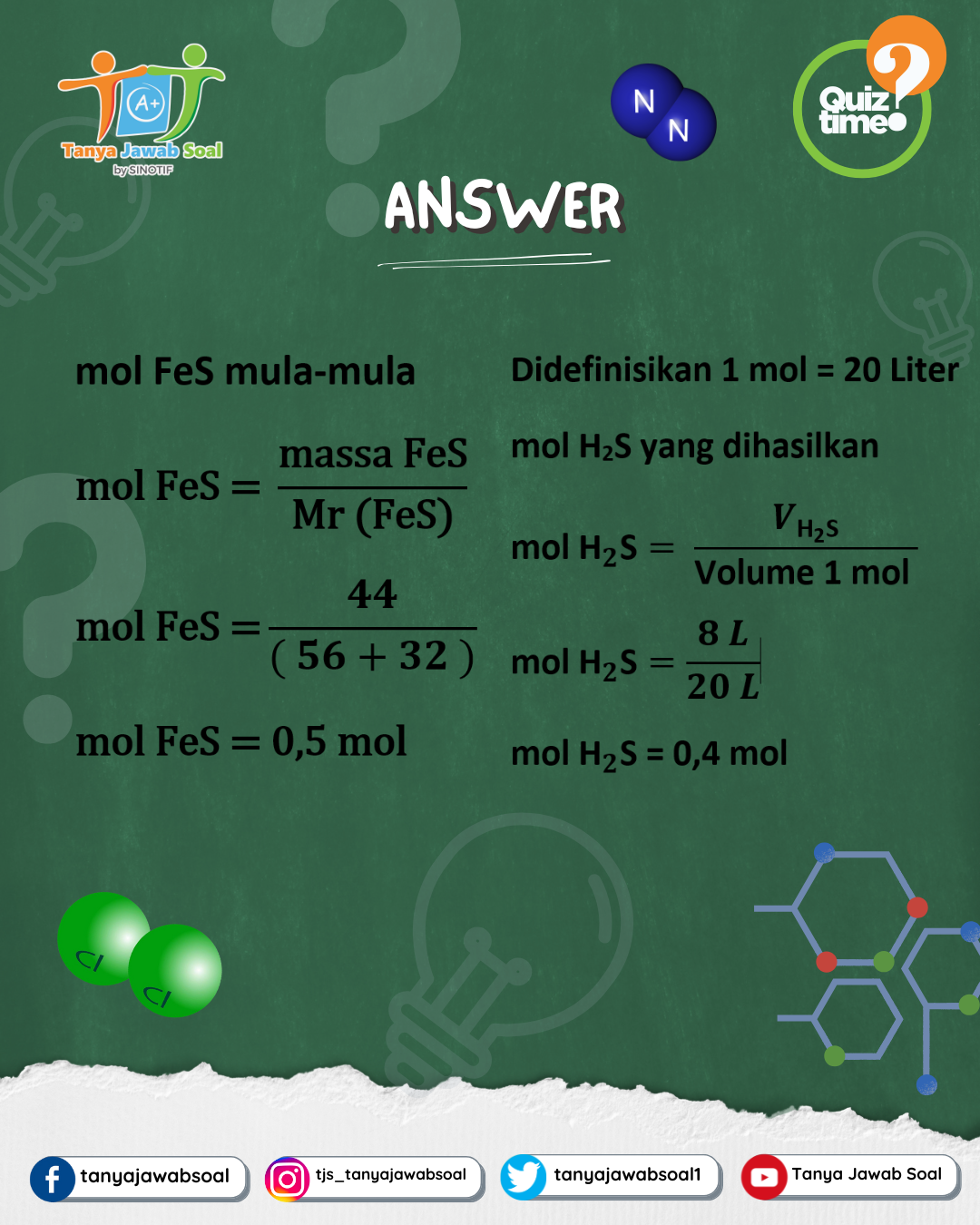
3. Mengubah Mol FeS Menjadi Massa
Mr FeS = Fe (56) + S (32) = 88 g/mol
FeS awal = 44 gram
Dari data ini, kita diminta menentukan berapa persen FeS yang benar-benar ikut bereaksi.
4. Langkah Penyelesaian
Perhitungan mol H₂S:
mol H2S = volume ÷ molar
volume = 8 L ÷ 20 L/mol = 0,4 mol
Langkah 1: Mengubah Volume Gas Menjadi Mol
Karena 1 mol gas setara dengan 20 liter
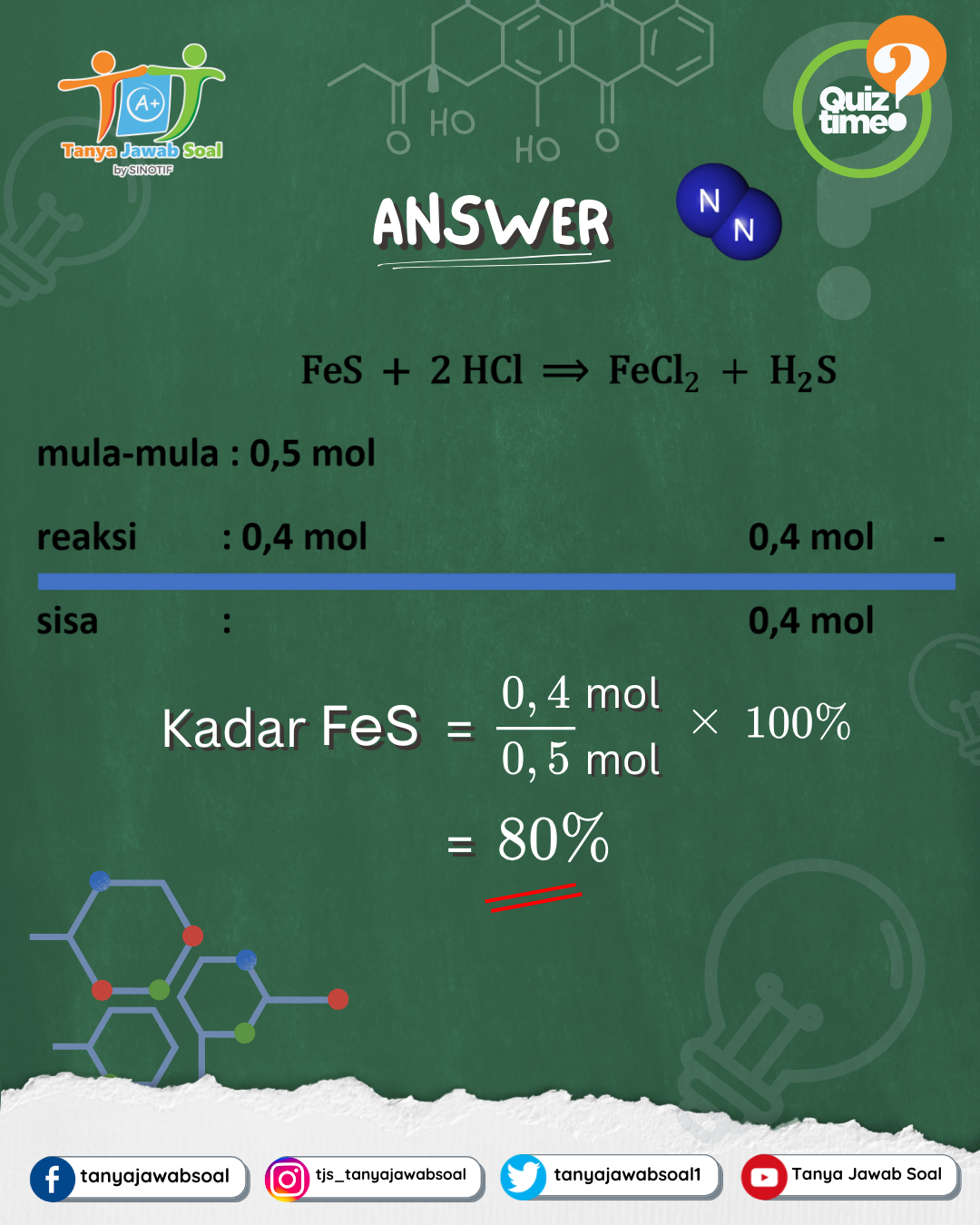
Langkah 2: Menentukan Mol FeS yang Bereaksi
Berdasarkan persamaan reaksi:
1 mol FeS → 1 mol H₂S
Berarti mol FeS yang bereaksi = 0,4 mol.
4. Kesimpulan
Dari perhitungan di atas, kita bisa simpulkan bahwa:
✨ Sebanyak 80% FeS ikut bereaksi menghasilkan gas H₂S. ✨
Dengan memahami cara kerja stoikiometri—hubungan antara mol, massa, dan volume gas—kamu bisa menyelesaikan soal-soal kimia SMA dengan lebih percaya diri.
Tetap semangat belajar bareng Tim100, ya Sobat100! 🔥💛






Komentar berhasil disembunyikan.