Halo Sobat100, melanjutkan pekan Hadiah Nobel artikel kali ini membahas pemenang Nobel 2020 bidang Kimia. Pengumuman diadakan pada Rabu, 7 Oktober 2020 pukul 11.45 waktu Swedia atau 16.45 WIB yang berlangsung di Royal Swedish Academy of Sciences (Kungl. Vetenskapsakademien, KVA), Sessionssalen, Lilla Frescativägen 4A, Stockholm. Hadiah Nobel Kimia 2020 dianugerahkan kepada Emmanuelle Charpentier dan Jennifer A. Doudna "untuk pengembangan metode pengeditan genom".

Emmanuelle Charpentier dan Jennifer Doudna dianugerahi Hadiah Nobel Kimia 2020 untuk penemuan salah satu alat paling tajam dari teknologi gen: gunting genetik CRISPR / Cas9. CRISPR-Cas9 adalah salah satu penemuan tak terduga dengan potensi yang menakjubkan. Ketika Emmanuelle Charpentier dan Jennifer Doudna mulai menyelidiki sistem kekebalan dari bakteri Streptococcus , satu gagasan adalah bahwa mereka mungkin dapat mengembangkan bentuk antibiotik baru. Sebaliknya, mereka menemukan alat molekuler yang dapat digunakan untuk membuat sayatan yang tepat pada materi genetik, sehingga memungkinkan untuk dengan mudah mengubah kode kehidupan.
1. Sejarah Awal
Pada tahun 1953, J.D. Watson dan F.H.C. Crick melaporkan struktur molekul DNA.[1] Setelah itu ilmuwan mencoba mengembangkan teknologi yang dapat memanipulasi materi genetik sel dan organisme. Dengan ditemukannya sistem CRISPR-Cas9 yang dipandu RNA, Metode rekayasa genom yang mudah dan efektif kini telah menjadi kenyataan. Perkembangan teknologi ini telah memungkinkan para ilmuwan untuk memodifikasi urutan DNA dalam berbagai sel dan organisme. Genomik manipulasi tidak lagi menjadi hambatan eksperimental. Saat ini, teknologi CRISPR-Cas9 digunakan secara luas dalam ilmu dasar, bioteknologi dan dalam pengembangan terapi masa depan.[2]
2. Alat canggih yang mempengaruhi semua orang
Hanya delapan tahun setelah penemuan mereka, gunting genetika ini telah membentuk kembali ilmu kehidupan. Ahli biokimia dan ahli biologi sel sekarang dapat dengan mudah menyelidiki fungsi dari berbagai gen dan kemungkinan perannya dalam perkembangan penyakit. Dalam pemuliaan tanaman, peneliti dapat memberikan ciri-ciri khusus tanaman, seperti kemampuan menahan kekeringan di iklim yang lebih hangat. Dalam pengobatan, editor gen ini berkontribusi pada terapi kanker baru dan studi pertama yang mencoba menyembuhkan penyakit bawaan.
Hampir tidak ada habisnya bagaimana CRISPR-Cas9 dapat digunakan, yang juga mencakup aplikasi yang tidak etis. Seperti semua teknologi canggih, gunting genetik ini perlu diatur. Lebih lanjut tentang itu nanti.
Pada tahun 2011, baik Emmanuelle Charpentier maupun Jennifer Doudna tidak tahu bahwa pertemuan pertama mereka, di sebuah kafe di Puerto Rico, adalah pertemuan yang mengubah hidup.
Berikut ini cerita dari Charpentier, yang awalnya mengusulkan kolaborasi mereka.
3. Charpentier terpesona oleh bakteri patogen
Beberapa orang menyebutnya didorong, penuh perhatian dan teliti. Yang lain mengatakan bahwa Emmanuelle Charpentier selalu mencari hal yang tidak terduga. Dia mengutip Louis Pasteur, "Kesempatan menguntungkan pikiran yang siap". Dorongan untuk membuat penemuan baru dan keinginan untuk bebas dan mandiri telah mengatur jalannya. Termasuk studi doktoralnya di Institut Pasteur di Paris, dia telah tinggal di lima negara berbeda, tujuh kota berbeda dan bekerja di sepuluh institusi berbeda.
Lingkungan dan pendekatannya telah bergeser, tetapi sebagian besar penelitiannya memiliki satu kesamaan: bakteri patogen. Mengapa mereka begitu agresif? Bagaimana mereka mengembangkan resistansi terhadap antibiotik? Dan apakah mungkin menemukan perawatan baru yang dapat menghentikan kemajuannya?
Pada tahun 2002, ketika Emmanuelle Charpentier memulai kelompok penelitiannya sendiri di Universitas Wina, dia berfokus pada salah satu bakteri yang menyebabkan kerusakan terbesar bagi umat manusia: Streptococcus pyogenes. Setiap tahun, penyakit ini menginfeksi jutaan orang, seringkali menyebabkan infeksi yang mudah diobati seperti tonsilitis dan impetigo. Namun, hal itu juga dapat menyebabkan sepsis yang mengancam jiwa dan merusak jaringan lunak dalam tubuh, membuatnya dikenal sebagai 'pemakan daging'.
Untuk lebih memahami S. pyogenes , Charpentier memulai dengan menyelidiki secara menyeluruh bagaimana gen bakteri ini diatur. Keputusan ini adalah langkah pertama dalam perjalanan menuju penemuan gunting genetik - tetapi sebelum kita melangkah lebih jauh di sepanjang jalan itu, kita akan mengetahui lebih banyak tentang Jennifer Doudna. Karena saat Charpentier membuat studi rinci tentang S. pyogenes , Doudna mendengar - untuk pertama kalinya - singkatan yang menurutnya terdengar lebih tajam .
4. Sains - petualangan sebanyak cerita detektif
Bahkan sebagai seorang anak yang tumbuh besar di Hawaii, Jennifer Doudna memiliki keinginan yang kuat untuk mengetahui banyak hal. Suatu hari, ayahnya meletakkan buku James Watson The Double Helix di tempat tidurnya. Kisah bergaya detektif tentang bagaimana James Watson dan Francis Crick memecahkan struktur molekul DNA tidak seperti yang pernah dia baca di buku pelajaran sekolahnya. Dia terpikat oleh proses ilmiah dan menyadari bahwa sains lebih dari sekadar fakta.
Namun, ketika dia mulai memecahkan misteri ilmiah, perhatiannya bukan pada DNA, tetapi pada saudara molekulernya: RNA. Pada tahun 2006 - ketika kami bertemu dengannya - dia memimpin sebuah kelompok penelitian di Universitas California, Berkeley, dan memiliki pengalaman dua dekade bekerja dengan RNA. Dia memiliki reputasi sebagai peneliti sukses dengan hidung untuk proyek-proyek terobosan, dan baru-baru ini memasuki bidang baru yang menarik: gangguan RNA .
Selama bertahun-tahun, para peneliti percaya bahwa mereka memahami fungsi dasar RNA, tetapi tiba-tiba mereka menemukan banyak molekul RNA kecil yang membantu mengatur aktivitas gen dalam sel. Keterlibatan Jennifer Doudna dalam gangguan RNA adalah alasan mengapa, pada tahun 2006, dia mendapat telepon dari seorang kolega di departemen yang berbeda.
5. Penemuan sistem CRISPR-Cas9
Pada 2011, jelas bahwa sistem CRISPR-Cas9 tersebar luas di prokariota dan berfungsi sebagaisistem kekebalan adaptif untuk memerangi bakteriofag dan plasmid yang menyerang (Gambar 1).
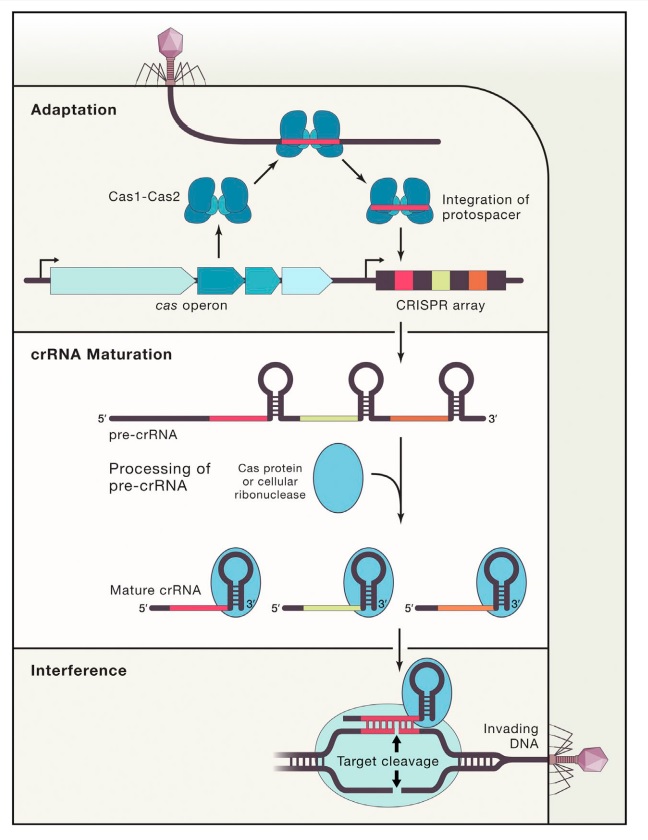
Gambar 1. Skema umum untuk fungsi sistem kekebalan adaptif CRISPR-Cas seperti yang disajikan. Tiga tahap diidentifikasi. Adaptasi: Fragmen pendek DNA untai ganda dari virus atau plasmid dimasukkan ke dalam susunan CRISPR pada DNA inang. crRNA Pematangan: Pre-crRNA diproduksi dengan transkripsi dan kemudian diproses lebih lanjut menjadi crRNA yang lebih kecil, masing-masing berisi satu spacer dan ulangi sebagian. Interferensi: Pembelahan dimulai saat crRNA mengenali dan secara khusus pasangan basa dengan wilayah pada plasmid atau DNA virus yang masuk. Interferensi dapat dipisahkan baik secara mekanis maupun sementara dari akuisisi dan ekspresi CRISPR.
Studi juga menetapkan bahwa protein Cas berfungsi pada tiga tingkat yang berbeda:
(i) integrasi urutan DNA spacer baru menjadi lokus CRISPR,
(ii) biogenesis crRNA, dan
(iii) pembungkaman menyerang asam nukleat.[3][4]
Identifikasi CRISPR-Cas9 sebagai alat untuk pengeditan genom berasal dari studi sistem CRISPR-Cas Kelas2, Tipe-II di S. thermophilus dan patogen manusia terkait Streptococcus. pyogenes. Sistem ini berisi empat gen cas, tiga di antaranya (cas1, cas2, csn2) terlibat di dalamnya akuisisi spacer, sedangkan yang keempat, cas9 (sebelumnya bernama cas5 dan csn1), diperlukan untuk gangguan.[5] Untuk mendukung gagasan ini, inaktivasi gen cas9 mencegah pembelahan DNA target.[6]
Untuk lebih menentukan elemen yang diperlukan untuk kekebalan, S. thermophilus Sistem CRISPR-Cas diperkenalkan ke E. coli, yang memberikan perlindungan heterolog melawan infeksi fag dan plasmid.[7]Menggunakan model eksperimental ini, bagian dari sistem dinonaktifkan untuk menentukan komponen yang diperlukan untuk perlindungan. Pekerjaannya jelas menunjukkan bahwa protein Cas9 saja sudah cukup untuk interferensi yang dikodekan langkah CRISPR, dan dua domain nuclease yang ada dalam protein, HNH dan RuvC, keduanya diperlukan untuk efek ini.
5. Penemuan tracrRNA dan perannya dalam pematangan crRNA
Pada 2011, Emmanuelle Charpentier dan rekannya melaporkan tentang mekanisme crRNA pematangan di S. pyogenes.[8]Menggunakan pengurutan RNA diferensial untuk mengkarakterisasi molekul RNA kecil tanpa kode, mereka mengidentifikasi lokus CRISPR aktif, berdasarkan ekspresi pra-crRNA dan molekul crRNA dewasa. Di luar dugaan, upaya pengurutan juga teridentifikasi melimpah Spesies RNA ditranskripsikan dari daerah 210 bp di hulu lokus CRISPR, sebaliknya untai dari array CRISPR (Gambar 2a).
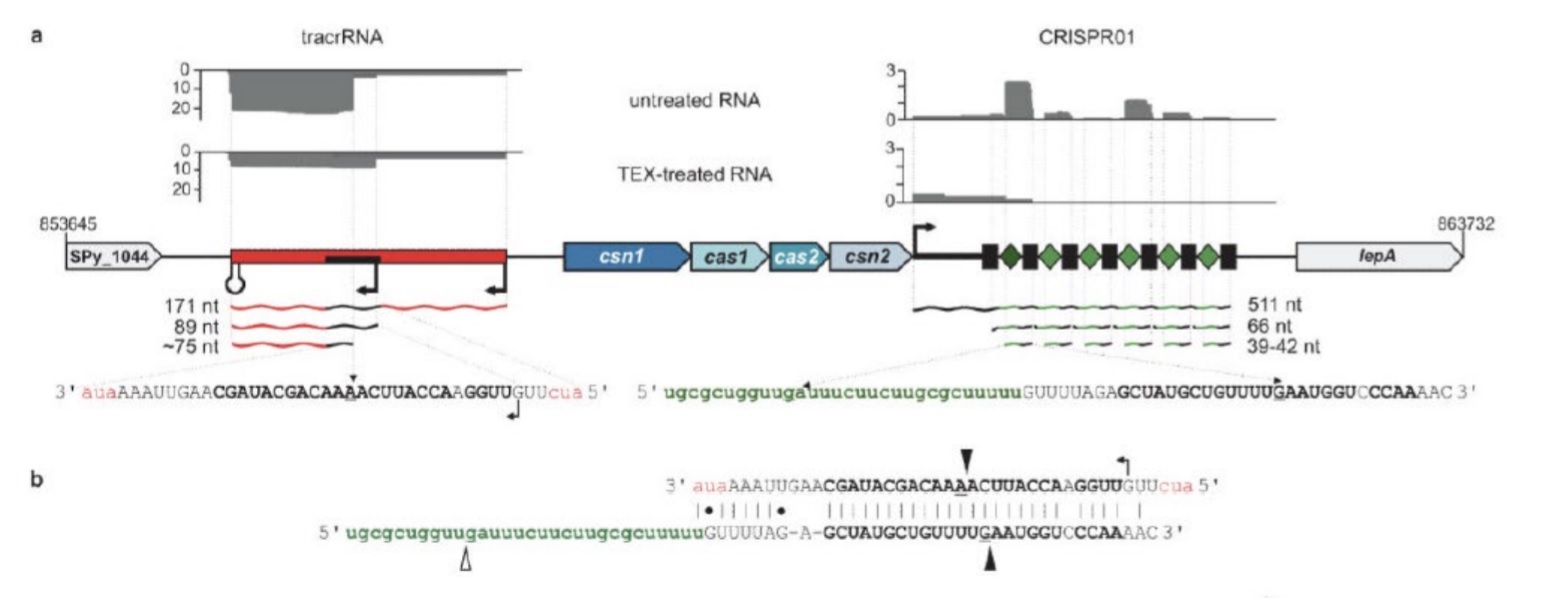
Gambar 2. Identifikasi tracrRNA di S. pyogenes seperti yang dilaporkan. A. Pengurutan RNA diferensial (dRNA-seq) mengungkapkan ekspresi tracrRNA dan crRNA. Urutan membaca perpustakaan cDNA dari RNA adalah ditampilkan di atas. Di bawah ini adalah organisasi genom tracrRNA dan lokus CRISPR01 / Cas. Bilah merah: tracrRNA dikodekan pada untai minus dan dideteksi sebagai spesies tracrRNA 171-, 89- dan ~ 75-nt. Persegi panjang hitam di dalam garis merah: regangan urutan 36-nt melengkapi CRISPR01 ulangi. Pre-crRNA dikodekan di file ditambah untai. Persegi panjang hitam: CRISPR01 berulang; berlian hijau: CRISPR01 spacer; 511, 66 dan 39-42 nt: pra-crRNA dan crRNA yang diproses. B. Pemasangan basa tracrRNA dengan pengulangan CRISPR01 diwakili.Pembelahan yang diamati oleh dRNA-seq dan mengarah ke pembentukan overhang pendek di ujung 3 'dariRNA yang diproses ditunjukkan oleh dua segitiga hitam.
Transkrip tersebut dilambangkan dengan trans-encoded small RNA (tracrRNA) dan berisi 25 nukleotida (nt) dengan komplementaritas yang hampir sempurna (ketidakcocokan 1-nt) dengan daerah berulang dari Lokus CRISPR, sehingga memprediksi pasangan basa dengan pra-crRNA. Wilayah dupleks RNA itu akan membentuk situs pemrosesan yang disertakan untuk pre-crRNA dan tracrRNA, yang segera menyarankan bahwa dua RNA dapat diproses bersama saat dipasangkan (Gambar 2b).
6. Pemahaman molekuler tentang mekanisme CRISPR
Saat ini, ada pemahaman struktural terperinci tentang bagaimana kompleks Cas9-gRNA mengenalinya menargetkan dan menengahi belahan dada. Informasi ini penting untuk upaya merekayasa baru versi sistem, dengan kekhususan PAM yang diubah dan mengurangi aktivitas di luar target. [9] Struktur Cas9 dalam bentuk bebas menunjukkan dua lobus yang berbeda, lobus pengenalan (REC) dan lobus nuclease (NUC), dengan yang terakhir berisi domain nuclease HNH dan RuvC. Saat Cas9 berikatan dengan sgRNA, ia mengalami penataan ulang struktural, dengan lobus REC bergerak menuju Domain HNH (Gambar 3).
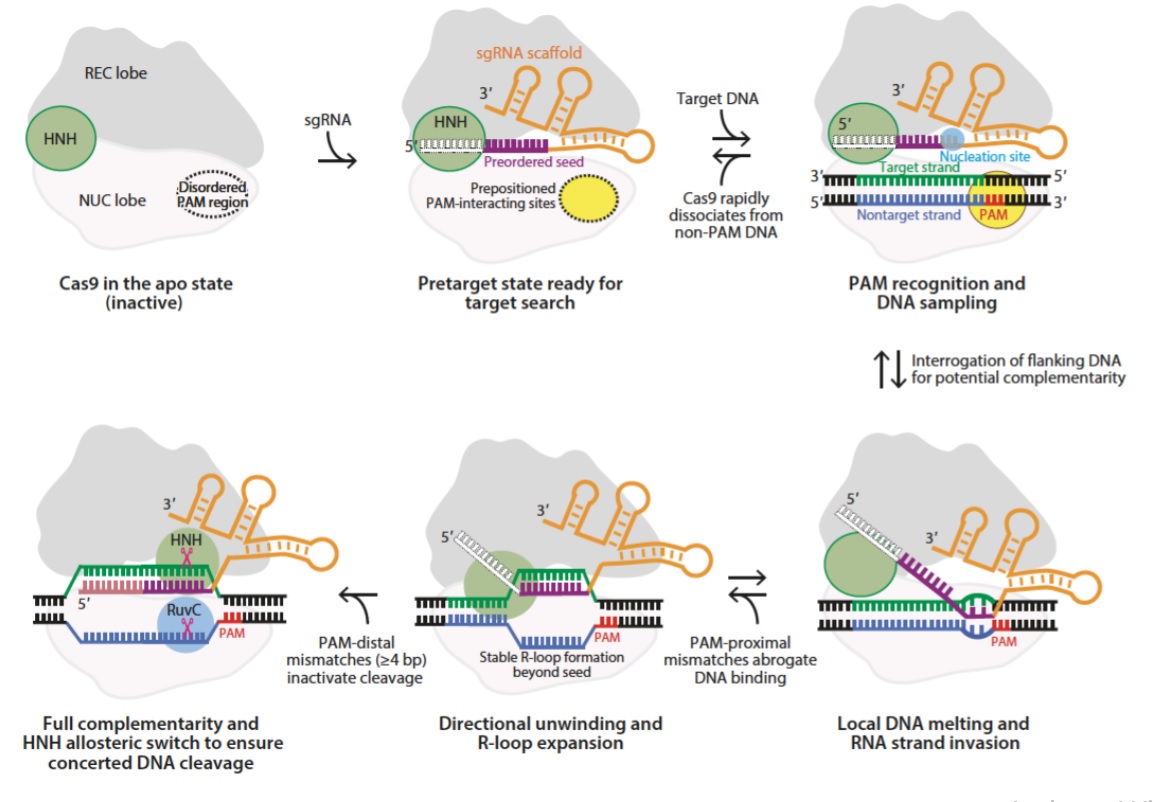
Gambar 3. Pengikatan sgRNA menyebabkan perubahan konformasi yang besar di Cas9. Di dalam konformasi yang diaktifkan, celah yang berinteraksi dengan PAM (lingkaran bertitik), menjadi terstruktur untuk PAM pengambilan sampel, dan urutan benih sgRNA diposisikan untuk menginterogasi DNA yang berdekatan untuk saling melengkapi ke sgRNA. Prosesnya dimulai dengan pengenalan PAM, yang pada langkah selanjutnya mengarah pada peleburan DNA lokal dan Invasi untai RNA. Ada perpanjangan bertahap dari formasi R-loop dan perubahan konformasi di domain HNH untuk memastikan pembelahan DNA bersama. Singkatan: bp, base pair; NUC, lobus nuclease; PAM, motif berdekatan protospacer; REC, lobus pengakuan; sgRNA, RNA panduan tunggal.
Untuk pengenalan target, urutan spacer 20-nt harus membentuk pasangan basa komplementer dengan urutan protospacer. Dalam struktur Cas9 dalam kompleks dengan sgRNA, urutan benih 10-nt di spacer mengadopsi konformasi bentuk-A dan diposisikan untuk terlibat dengan urutan target dalam DNA. [10][11] Urutan benih terletak di ujung 3 ′ dari urutan spacer 20-nt dan adalah penting untuk pengenalan target.[12] Dalam pengeditan genom, kesamaan antara benih urutan dan urutan genom dapat menyebabkan efek di luar target, meskipun ada banyak ketidakcocokan di tempat lain di wilayah spacer sgRNA.[13]
7. Gunting genetik mengubah ilmu kehidupan
Setelah Emmanuelle Charpentier dan Jennifer Doudna segera mempublikasikan penemuan gunting genetik CRISPR / Cas9 pada tahun 2012, beberapa kelompok penelitian menunjukkan bahwa alat ini dapat digunakan untuk memodifikasi genom dalam sel dari tikus dan manusia, yang mengarah pada perkembangan eksplosif.
Sebelumnya, mengubah gen dalam sel, tumbuhan, atau organisme memakan waktu lama dan terkadang tidak mungkin. Dengan menggunakan gunting genetika, para peneliti dapat - pada prinsipnya - memotong genom mana pun yang mereka inginkan. Setelah ini, sistem alami sel untuk perbaikan DNA mudah digunakan sehingga mereka dapat menulis ulang kode kehidupan.
Karena alat gen ini sangat mudah digunakan, kini tersebar luas dalam penelitian dasar. Ini digunakan untuk mengubah DNA sel dan hewan laboratorium untuk tujuan memahami bagaimana gen yang berbeda berfungsi dan berinteraksi, seperti selama perjalanan penyakit.
Gunting genetik juga menjadi alat standar dalam pemuliaan tanaman. Metode yang sebelumnya digunakan oleh para peneliti untuk memodifikasi genom tanaman seringkali membutuhkan penambahan gen untuk resistensi antibiotik. Pada saat tanaman ditanam terdapat resiko resistensi antibiotik ini menyebar ke mikroorganisme sekitarnya.
Berkat gunting genetik, para peneliti tidak perlu lagi menggunakan metode lama ini karena mereka sekarang dapat membuat perubahan yang sangat tepat pada genom. Antara lain, mereka telah mengedit gen yang membuat beras menyerap logam berat dari tanah, sehingga menghasilkan varietas padi yang lebih baik dengan kadar kadmium dan arsen yang lebih rendah. Para peneliti juga telah mengembangkan tanaman yang lebih tahan terhadap kekeringan di iklim yang lebih hangat, dan yang tahan terhadap serangga dan hama yang jika tidak harus ditangani dengan menggunakan pestisida.
Harapan menyembuhkan penyakit bawaan
Dalam pengobatan, gunting genetik berkontribusi pada imunoterapi baru untuk kanker dan percobaan sedang dilakukan untuk membuat mimpi menjadi kenyataan - menyembuhkan penyakit bawaan. Para peneliti sudah melakukan uji klinis untuk menyelidiki apakah mereka dapat menggunakan CRISPR / Cas9 untuk mengobati penyakit darah seperti anemia sel sabit dan talasemia beta, serta penyakit mata yang diturunkan.
Mereka juga mengembangkan metode untuk memperbaiki gen di organ besar, seperti otak dan otot. Percobaan pada hewan telah menunjukkan bahwa virus yang dirancang khusus dapat mengirimkan gunting genetik ke sel yang diinginkan, mengobati model penyakit bawaan yang menghancurkan seperti distrofi otot, atrofi otot tulang belakang, dan penyakit Huntington. Namun, teknologi tersebut perlu penyempurnaan lebih lanjut sebelum dapat diujicobakan pada manusia.
8. Kekuatan gunting genetik membutuhkan regulasi
Di samping semua manfaatnya, gunting genetik juga bisa disalahgunakan. Misalnya, alat ini dapat digunakan untuk membuat embrio hasil rekayasa genetika. Namun, selama bertahun-tahun telah ada undang-undang dan peraturan yang mengontrol penerapan rekayasa genetika, yang mencakup larangan memodifikasi genom manusia dengan cara yang memungkinkan perubahan diwariskan. Selain itu, eksperimen yang melibatkan manusia dan hewan harus selalu ditinjau dan disetujui oleh komite etika sebelum dilakukan.
Satu hal yang pasti: gunting genetik ini mempengaruhi kita semua. Kita akan menghadapi masalah etika baru, tetapi alat baru ini mungkin berkontribusi untuk menyelesaikan banyak tantangan yang sekarang dihadapi umat manusia. Melalui penemuan mereka, Emmanuelle Charpentier dan Jennifer Doudna mengembangkan alat kimia yang telah membawa ilmu kehidupan ke zaman baru. Mereka telah membuat kita memandang ke cakrawala luas dari potensi yang tak terbayangkan dan, di sepanjang jalan - saat kita menjelajahi negeri baru ini - kita dijamin akan membuat penemuan baru dan tak terduga.
9. Biografi Pemenang Nobel 2020 Bidang Kimia
- Emmanuelle Charpentier

Penghargaan Nobel Kimia 2020
Lahir: 11 Desember 1968, Juvisy-sur-Orge, Prancis
Afiliasi pada saat pemberian penghargaan: Unit Max Planck untuk Ilmu Patogen, Berlin, Jerman
Motivasi hadiah: "untuk pengembangan metode pengeditan genom."
Pembagian hadiah: 1/2
- Jennifer A. Doudna

Penghargaan Nobel Kimia 2020
Lahir: 19 Februari 1964, Washington, DC, AS
Afiliasi pada saat penghargaan: University of California, Berkeley, CA, USA
Motivasi hadiah: "untuk pengembangan metode pengeditan genom."
Pembagian hadiah: 1/2
Penulis : Lina
Editor : Rosyid
DAFTAR PUSTAKA
- ^ Watson, J.D. and F.H. 1953. Crick, Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid. Nature, 171(4356): p. 737-8.
- ^ Knott, G.J. and J.A. Doudna. 2018. CRISPR-Cas guides the future of genetic engineering. Science, 361(6405): p. 866-869.
- ^ Bhaya, D., M. Davison, and R. Barrangou. 2011. CRISPR-Cas systems in bacteria and archaea: versatile small RNAs for adaptive defense and regulation. Annu Rev Genet, 45: p. 273-97.
- ^ Terns, M.P. and R.M. Terns. 2011. CRISPR-based adaptive immune systems. Curr Opin Microbiol, 14(3): p. 321-7.
- ^ Barrangou, R., et al. 2007. CRISPR provides acquired resistance against viruses in prokaryotes. Science, 315(5819): p. 1709-12.
- ^ Garneau, J.E., et al. 2010. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature, 468(7320): p. 67-71.
- ^ Sapranauskas, R., et al. 2011. The Streptococcus thermophilus CRISPR/Cas system provides immunity in Escherichia coli. Nucleic Acids Res, 39(21): p. 9275-82.
- ^ Deltcheva, E., et al. 2011. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature, 471(7340): p. 602-7.
- ^ Jiang, F. and J.A. Doudna. 2017. CRISPR-Cas9 Structures and Mechanisms. Annu Rev Biophys, 46: p. 505-529.
- ^ Jinek, M., et al. 2014. Structures of Cas9 endonucleases reveal RNA-mediated conformational activation. Science, 343(6176): p. 1247997.
- ^ Jiang, F., et al. 2015. STRUCTURAL BIOLOGY. A Cas9-guide RNA complex preorganized for target DNA recognition. Science, . 348(6242): p. 1477-81.
- ^ Sternberg, S.H., et al. 2014. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature, 507(7490): p. 62-7.
- ^ Pattanayak, V., et al. 2013. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol, 31(9): p. 839-43.






Komentar berhasil disembunyikan.